Para que un soluto que se encuentra en fase líquida en una disolución cristalice, es necesario sobresaturar dicha disolución. Pero ¿qué significa sobresaturar? Para entender este concepto, necesitamos definir en primer lugar el concepto de disolución saturada.
SATURACIÓN Y SOBRESATURACIÓN
La saturación es un estado de equilibrio termodinámico. En una disolución conteniendo cristales macroscópicos, cuando se alcanza el equilibrio entre la disolución y la fase sólida del soluto que forma parte de la misma (cristales), dicha disolución en equilibrio con los cristales es una disolución saturada. La concentración de saturación se representa con una C* y, para cada sustancia, variará en función de la temperatura. El resultado de esta variación de la concentración con respecto de la temperatura se representa gráficamente en un diagrama conocido como diagrama de saturación o diagrama de solubilidad.
Definido el estado saturado, podemos definir una disolución sobresaturada como aquélla que contiene más soluto en disolución que el que viene dado por su condición de equilibrio termodinámico. En esta situación, la disolución se encuentra en situación de equilibrio inestable (metaestable o lábil) y su estado podría cambiar si se desencadenan los mecanismos de nucleación que llevarían a la formación de cristales y, en consecuencia, dirigirían disolución hacia una situación de equilibrio termodinámico o saturación. No obstante, es necesario cierto grado de sobresaturación para que se desencadenen dichos mecanismos. Esta sobresaturación se mide como la diferencia entre la concentración de la disolución (C) y la concentración de saturación (C*): ΔC = C-C*, siendo este gradiente la fuerza impulsora del proceso de cristalización. La cantidad de energía (sobresaturación) necesaria para desencadenar la nucleación dependerá de las características de la disolución y del equipo, así como de la existencia o no de cristales macroscópicos en el magma, es decir, del tipo de nucleación (ver esta entrada).
DIAGRAMA DE SATURACIÓN-SOBRESATURACIÓN DE MIERS E ISAAC
Definidos el estado saturado y sobresaturado, Miers e Isaac proponen el siguiente diagrama, conocido como diagrama de saturación-sobresaturación, o bien diagrama de solubilidad-sobresaturación.
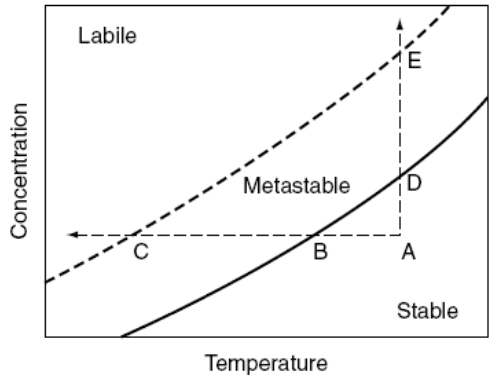
En este diagrama se distinguen dos curvas: la curva de solubilidad o saturación (continua) y la curva de sobresaturación (discontinua). La curva de saturación o solubilidad define, para un compuesto en particular, la concentración de saturación para cada temperatura. Por su parte, la curva de sobresaturación indica la zona en la cual la probabilidad de nucleación espontánea (ver esta entrada) aumenta de forma significativa.
Estas curvas permiten diferenciar varias regiones en el diagrama:
- Región estable: se trata de una zona insaturada, donde no tendrán lugar los fenómenos de nucleación o crecimiento del cristal, dado que no existe sobresaturación. Es la región por debajo de la curva de saturación o solubilidad.
- Región metaestable: se trata de una zona sobresaturada, donde la nucleación espontánea es muy improbable, aunque sí podrían darse los fenómenos de nucleación secundaria y crecimiento del cristal. Se trata de la región entre ambas curvas.
- Región lábil o inestable: se trata también de una zona sobresaturada, pero en este caso la probabilidad de que tenga lugar la nucleación espontánea es muy elevada. Es la zona más alejada de la curva de solubilidad/sobresaturación, en la que pueden aparecer núcleos por nucleación primaria (espontánea) dado que la fuerza impulsora (sobresaturación) es mayor.
