Para cristalizar se necesita sobresaturar la disolución, lo cual implica obtener una disolución con una concentración de solutos mayor a la que viene dada por su equilibrio termodinámico, es decir, por su curva de saturación.
Existen diferentes formas de alcanzar la sobresaturación:
- Por concentración.
- Por enfriamiento.
- Por reacción o desplazamiento del equilibrio.
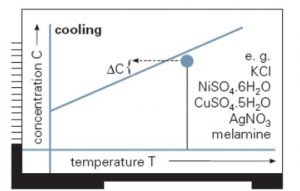
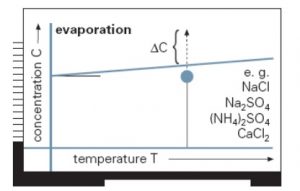
Si la solubilidad del soluto aumenta fuertemente con la temperatura, como ocurre frecuentemente con muchas sales inorgánicas y sustancias orgánicas, una solución saturada se transforma en sobresaturada disminuyendo la temperatura por enfriamiento. Si la solubilidad es relativamente independiente de la temperatura como en el caso de sal común, la sobresaturación se puede conseguir evaporando parte del disolvente. Por último, si la solubilidad es muy elevada estos métodos pueden no resultar adecuados, por lo que se recurre a añadir un tercer componente, lo que se conoce como cristalización por reacción o desplazamiento del equilibrio. El tercer componente puede actuar físicamente dando lugar a una mezcla con el disolvente original en la que la solubilidad del soluto disminuye bruscamente, o bien se puede crear químicamente un nuevo soluto añadiendo un tercer componente que reaccione con el soluto original para formar una sustancia insoluble. En determinados casos, se combinan ambos procesos (evaporación y enfriamiento) para conseguir la sobresaturación necesaria.
A continuación se muestra cómo alcanzar la sobresaturación sobre curvas de solubilidad de (A. izquierda) compuestos cuya solubilidad varía significativamente con la temperatura y (B. derecha) compuestos cuya solubilidad no varía significativamente con la temperatura. Para los primeros, el enfriamiento es una buena forma de conseguir la sobresaturación, mientras que para cristalizar los segundos es necesario concentrar la disolución.
En cualquier caso, la fuerza impulsora del proceso de cristalización es la sobresaturación, de forma que tanto la nucleación como el crecimiento del cristal se darán únicamente si la disolución está sobresaturada.
CRISTALLIZATION PROCESSES
Crystallization can only take place when a solution is supersaturated, which implies obtaining a solution with a concentration higher than the given by its thermodynamic equilibrium, that is, the given by its saturation or solubility curve.
There are different ways of supersaturating a solution:
- Concentration
- Cooling
- Reaction or equilibrium displacement
If solubility significantly depends on temperature, as occurs with some inorganic salts and organic substances, a saturated solution transforms into a supersaturated one by cooling. In contrast, if solubility is rather temperature independent, as in the case of NaCl, supersaturation is better achieved by evaporating part of the solvent. In most cases, both cooling and concnetration are combined to obtain the desired supersaturation. Finally, if solubility is significantly high these methods may not be adequate, for which it is common to modify the component solubility by adding a third compound, this procedure is known as crystallization by reaction or equlibrium displacement. The third component may act physically by creating a mixture with the original solvent, i which the solute solubility decreases dramatically, or either chemically creating a new solute which solubility in the original solvent is very low.
Next, the ways in which supersaturation may be reached on different solubility curves/lines are shown: (A. left) Solutes which solubility significantly varies with temperature and (B. right) compounds which solubility does not significantly vary with temperature. For the former, cooling is a good way of reaching supersaturation, whereas the latter require concentration by solvent removal.
In any case, supersaturation is the driving force for crystallization, so that both nucleation and crystal growth can only take place when the solution is supersaturated.